Keine falsche Bewegung – Zellmigration unter der Lupe
Der Weg von A nach B kann mühsam sein, vor allem für Zellen. Ein internationales Team von Wissenschaftler*innen am Heidelberger Institut für Theoretische Studien (HITS) und der Universität Helsinki hat sich die biochemischen und biomechanischen Prozesse näher angeschaut, die der Zellmigration zugrunde liegen. Dazu nahmen sie einen der Hauptakteure ins Visier, die Pseudokinase ILK. Die Ergebnisse der Studie wurden nun in der Fachzeitschrift „Proceedings of the National Academy of Sciences“ (PNAS) veröffentlicht, und tragen wesentlich zum Verständnis dieses faszinierenden Proteins bei.
Während die überwältigende Mehrheit unserer Zellen sich im Laufe ihres Lebens nur wenig von ihrem ursprünglichen Standort wegbewegt und dabei lediglich kürzere Strecken zurücklegt, gibt es andere spezialisierte Zelltypen, die sich frei und schnell bewegen müssen, um ihren Aufgaben nachzukommen. Dazu gehören zum Beispiel Immunzellen, aber auch die sogenannten Fibroblasten, die für diese Studie verwendet wurden, und die unter anderem an der Wundheilung beteiligt sind. Aber ob nun schnell oder langsam, träge oder agil – für alle Zellen ist die richtige Balance zwischen struktureller Stabilität und Flexibilität enorm wichtig und dabei müssen sie auf eine Vielzahl biochemischer und mechanischer Signale ihrer Nachbarzellen und der Matrix, in die sie eingebettet sind, reagieren.
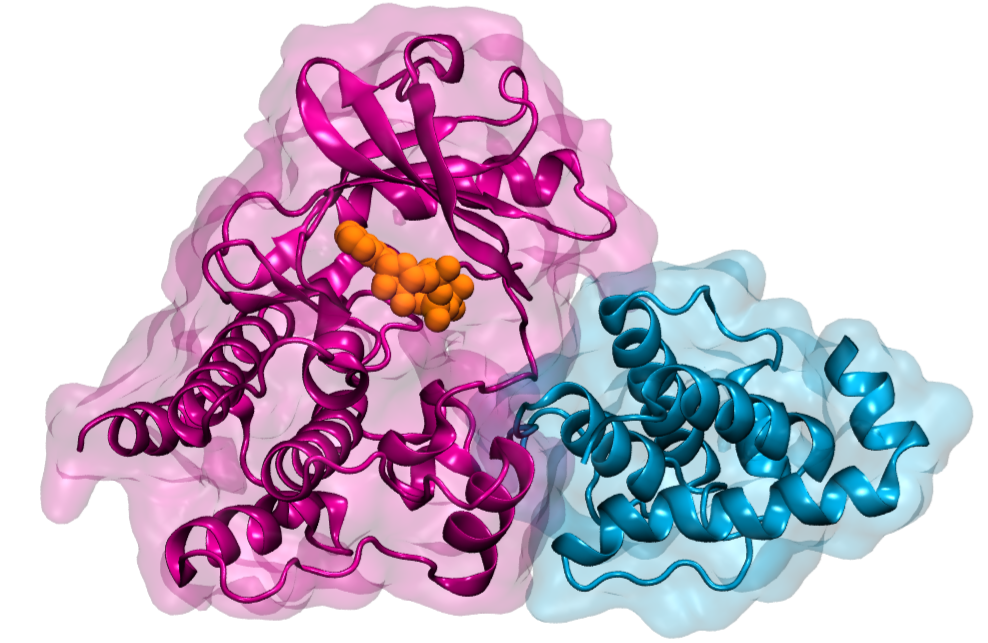
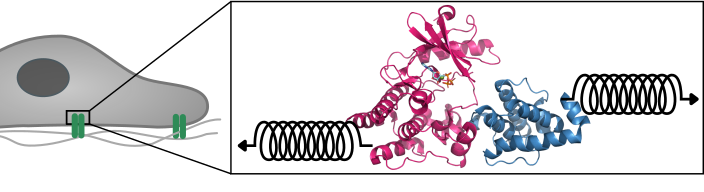
In der Praxis übernehmen große Proteinkomplexe diese Signalübertragung zwischen der Zelle und der Matrix. Ein entscheidendes Protein in diesem Komplex ist die Integrin-Linked Kinase (ILK). “Als Pseudokinase ist ILK nicht in der Lage, eine chemische Reaktion zu katalysieren, wie das bei klassischen Kinasen der Fall ist,” so Erstautorin Isabel Martin aus der Forschungsgruppe “Molekulare Biomechanik” (MBM) am HITS. “Uns hat daher besonders interessiert, aus welchem Grund ILK dennoch ATP bindet – das kleine Molekül, das normalerweise für die Katalyse verwendet wird – und wie all dies mit der Zellbewegung zusammenhängt.”
Mithilfe von Molekulardynamiksimulationen, die mit zellbiologischen Untersuchungsmethoden und Kraftmessungen einzelner Zellen im Labor von Sara Wickström an der Universität Helsinki kombiniert wurden, untersuchten Martin und ihre Kolleg*innen die Rolle der ATP-Bindung an menschliche ILK, und schauten sich dabei die veränderte Dynamik der Kinasen und das Verhalten der Zelle nach dem Entfernen von ATP genauer an.
“Durch Simulationen gelang es uns, ILK bis ins molekulare Detail zu analysieren und wir stellten dabei fest, dass ILK durch ATP strukturelle Stabilität erhält. Dieser Effekt ist das Ergebnis eines internen Kraftübertragungswegs von ATP zu Regionen im Protein, die ein wichtiges Adapterprotein binden,” so Martin. “Wir nehmen an, dass dabei ATP in ILK eine neue unvorhergesehene Rolle einnimmt, die darin besteht, die ILK zu unterstützen, mechanische Kräfte weiterzuleiten, indem es ihr strukturelle Stabilität verleiht.”
Im nächsten Schritt überprüften die Wissenschaftler*innen die Vorhersagen ihrer Simulationen und gingen dabei weit über die Zeit- und Längenskalen der ursprünglichen Simulationen hinaus. Um die großskaligen Auswirkungen einer beibehaltenen ATP-Bindung an ILK in der Zelle zu untersuchen, arbeiteten sie mit Kolleg*innen in Finnland zusammen.
“Motiviert durch die neuen Erkenntnisse aus den Computersimulationen, die am HITS durchgeführt worden waren, überprüften wir die Vorhersagen, indem wir Zellen mit einem mutierten ILK-Protein herstellten, das nicht in der Lage ist, ATP zu binden. Und in der Tat bewegten sich diese Zellen weniger effizient als die normalen Zellen, bei denen ATP an ILK binden und ILK dadurch stärken kann,” erläutert Sara Wickström, Leiterin der Studie an der Universität Helsinki, die experimentellen Ergebnisse.
Die große Überraschung dabei war, dass ATP hier seine konventionelle biochemische Rolle aufgibt und als mechanischer Stabilisator auftritt – ein kleines Molekül macht den großen Unterschied. Frauke Gräter, Leiterin der MBM-Gruppe am HITS und Ko-autorin der Studie, fasst die Ergebnisse der Studie zusammen: “Unsere Ergebnisse sind ein weiteres Puzzlestück hin zu einem besseren Verständnis davon, was Zellen einerseits an ihrem gewünschten Standort hält, und es ihnen gleichzeitig ermöglicht, ihn wenn nötig zu wechseln.”

Publikation:
Isabel M. Martin, Michele M. Nava, Sara A. Wickström, and Frauke Gräter: ATP allosterically stabilizes integrin-linked kinase for efficient force generation. PNAS, Vol. 119 | No. 11. https://www.pnas.org/doi/10.1073/pnas.2106098119
Wissenschaftlicher Kontakt:
Prof. Dr. Frauke Gräter
Molecular Biomechanics Group (MBM)
Heidelberger Institut für Theoretische Studien (HITS)
https://www.h-its.org/de/people/prof-dr-frauke-grater/
Isabel Martin
Molecular Biomechanics Group (MBM)
Heidelberger Institut für Theoretische Studien (HITS)
https://www.h-its.org/people/isabel-martin/
Prof. Dr. Sara Wickström
Helsinki Institute of Life Science, Biomedicum Helsinki, University of Helsinki, Finland
https://www2.helsinki.fi/en/researchgroups/stem-cells-and-tissue-architecture/people#section-47730
Medienkontakt:
Dr. Peter Saueressig
Head of Communications
Heidelberger Institut für Theoretische Studien (HITS)
peter.saueressig@h-its.org
Anu Koivusipilä
Communications specialist
University of Helsinki. Finland
anu.koivusipila@helsinki.fi
Über das HITS
Das HITS (Heidelberger Institut für Theoretische Studien) wurde 2010 von dem Physiker und SAP-Mitbegründer Klaus Tschira (1940-2015) und der Klaus Tschira Stiftung als privates, gemeinnütziges Forschungsinstitut gegründet. Es betreibt Grundlagenforschung in den Naturwissenschaften, der Mathematik und der Informatik. Zu den Hauptforschungsrichtungen zählen komplexe Simulationen auf verschiedenen Skalen, Datenwissenschaft und -analyse sowie die Entwicklung rechnergestützter Tools für die Forschung. Die Anwendungsfelder reichen von der Molekularbiologie bis zur Astrophysik. Ein wesentliches Merkmal des Instituts ist die Interdisziplinarität, die in zahlreichen gruppen- und disziplinübergreifenden Projekten umgesetzt wird. Die Grundfinanzierung des HITS wird von der Klaus Tschira Stiftung bereitgestellt.