Der berechnete Tumor – Algorithmen unterstützen die Suche nach Impfstoffen gegen Krebs
Bösartige Tumoren entstehen durch Veränderungen des Erbguts, sogenannte Mutationen. Bei einem Teil dieser Tumoren, den Mikrosatelliten-instabilen Tumoren (kurz: MSI), entstehen diese Mutationen durch nicht reparierte Fehler, die bei der Verdopplung des Erbguts während der Zellteilung auftreten. Wissenschaftler/-innen des Heidelberger Instituts für Theoretische Studien (HITS), des Deutschen Krebsforschungszentrums (DKFZ), des Universitätsklinikums und der Universität Heidelberg ist es nun mithilfe eines speziell entwickelten Algorithmus gelungen, Mutationen zu identifizieren, die in identischer Form bei zahlreichen Patienten übereinstimmen und die darüber hinaus zu Veränderungen in der Proteinstruktur führen. Eine Impfung gegen diese veränderten Proteine könnte die Entstehung von MSI-Tumoren im Keim ersticken.
Pro Sekunde teilen sich im menschlichen Körper Millionen Zellen, dabei wird vorhandenes Erbgut kopiert und verdoppelt. Dieser Prozess läuft meist reibungslos ab, auftretende Probleme werden durch zelleigene Kontroll- und Reparaturmechanismen weitgehend beseitigt. Versagen diese Mechanismen jedoch, kommt es zu Veränderungen im Erbgut, die Proteinstruktur der Zellen verändert sich und MSI-Tumoren können entstehen. Alleine in Deutschland werden jedes Jahr mehr als 15.000 solcher Tumoren neu diagnostiziert, weltweit geht man von rund 500.000 aus. Dabei treten MSI-Tumoren insbesondere bei Tumoren des Darms und der Gebärmutter auf, oft auch im Rahmen eines erblichen Tumorsyndroms (Lynch-Syndrom). In Deutschland sind bis zu einer halben Million Menschen vom Lynch-Syndrom betroffen. Sie haben ein erblich bedingtes Risiko von über 50%, im Laufe ihres Lebens an Darmkrebs oder Gebärmutterkrebs zu erkranken.
Die durch das veränderte Erbgut entstehenden neuen Proteinstrukturen, auch Neoantigene genannt, werden aufgrund der großen Zahl von Mutationen vom Immunsystem als körperfremd erkannt und könnten mit Immuntherapien behandelt werden. Bislang war jedoch nicht bekannt, ob diese Neoantigene bei Mikrosatelliten-instabilen Krebsarten nach dem Zufallsprinzip entstehen oder ob es bestimmte Häufigkeiten gibt.
Um dieser Frage auf den Grund zu gehen, initiierte ein Forschungsteam der Abteilung für Angewandte Tumorbiologie (ATB) des Universitätsklinikums Heidelberg eine Studie, um neue Ansätze zur Prävention und Therapie dieser Tumoren auszuloten. Sie nutzten dafür einen kürzlich am Klinikum, der Universität Heidelberg und am HITS entwickelten Algorithmus, der die Mutationen in den MSI-Tumorzellen präzise nachweisen kann. „Der Algorithmus ist in der Lage, Fehler, die bei der Auswertung der Daten auftreten können, von den realen Mutationen in Tumoren zu unterscheiden. Dies war mit den bisherigen Auswertungsmethoden nur schwer möglich“, so Saskia Haupt vom EMCL der Universität Heidelberg und Gastwissenschaftlerin am HITS. Dadurch gelang es, Mutationen zu identifizieren, die in genau der gleichen Weise immer wieder in MSI-Tumoren verschiedener Patienten auftreten.
Weiterhin konnte das Team zum ersten Mal direkt nachweisen, dass die Überwachung der Tumorentstehung durch das Immunsystem unmittelbare Spuren im Erbgut von klinisch diagnostizierten MSI-Tumoren hinterlässt. In einem zweiten Schritt konnten die Wissenschaftler/-innen vorhersagen, welche dieser Neoantigene dazu fähig sind, das Immunsystem zu aktivieren.
„Die quantitative Auswertung der molekularen und genetischen Daten zeigt, wie wertvoll die enge interdisziplinäre Zusammenarbeit von Medizinern, Tumorbiologen, Mathematikern und Informatikern ist“, fasst Vincent Heuveline, Leiter des EMCL und Gruppenleiter am HITS, die Ergebnisse zusammen.
Die Studie, die jetzt im Fachjournal „Nature Communications“ publiziert wurde, legt nahe, dass das Immunsystem eine ganz wesentliche Rolle dabei spielt, Tumorvorstufen zu erkennen und zu eliminieren. Da die Erbgutveränderungen und immunologisch relevanten Strukturen, die bei der Entstehung von MSI-Tumoren auftreten, bereits vor der Tumorentstehung bekannt sind, könnte eine gezielte Stimulation des Immunsystems, zum Beispiel durch eine Impfung, die Tumorentstehung im Keim ersticken.
Publikation in „Nature Communications“:
Alexej Ballhausen, Moritz Jakob Przybilla, Michael Jendrusch, Saskia Haupt, Elisabeth Pfaffendorf, Markus Draxlbauer, Florian Seidler, Sonja Krausert, Aysel Ahadova, Martin Simon Kalteis, Daniel Heid, Damian Stichel, Johannes Gebert, Maria Bonsack, Sarah Schott, Hendrik Bläker, Toni Seppälä, Jukka-Pekka Mecklin, Sanne Ten Broeke, Maartje Nielsen, Vincent Heuveline, Julia Krzykalla, Axel Benner, Angelika Beate Riemer, Magnus von Knebel Doeberitz, Matthias Kloor: The shared neoantigen landscape of MSI cancers suggests immunoediting during tumor evolution
Nature Communications 2020, DOI: 10.1038/s41467-020-18514-5. https://www.nature.com/articles/s41467-020-18514-5
Zur Pressemitteilung des DKFZ.
Der Source-Code des neu entwickelten ReFrame-Algorithmus ist auf GitHub zugänglich: (https://github.com/atb-data/neoantigen-landscape-msi).
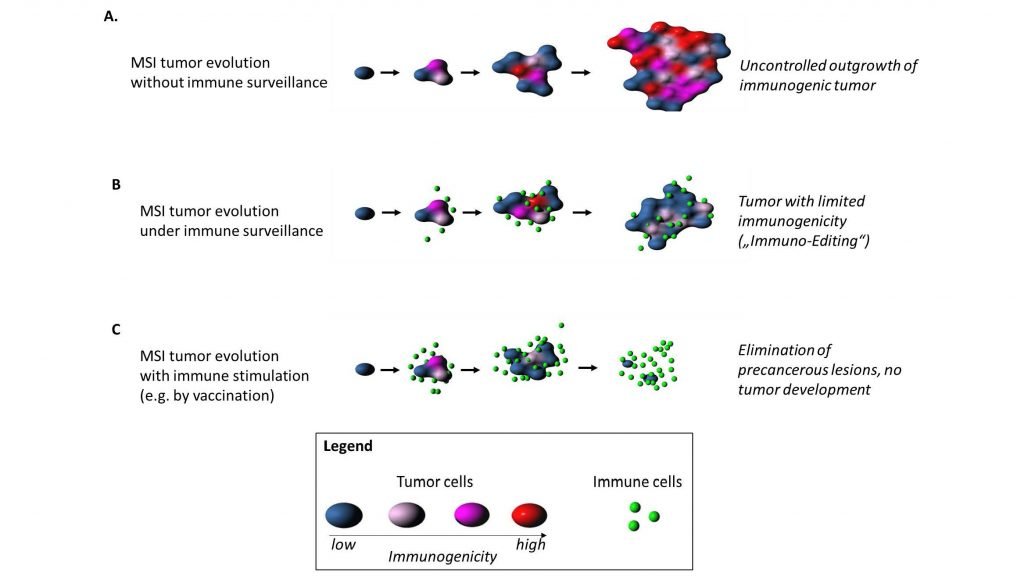
Tumorimmuninteraktion bei MSI-Tumoren: ohne Immunüberwachung (A), mit Immunüberwachung (B) und mit Immunstimulation (C). © Matthias Kloor, Angewandte Tumorbiologie, Universitätsklinikum Heidelberg.
Über das HITS
Das HITS (Heidelberger Institut für Theoretische Studien) wurde 2010 von dem Physiker und SAP-Mitbegründer Klaus Tschira (1940-2015) und der Klaus Tschira Stiftung als privates, gemeinnütziges Forschungsinstitut gegründet. Es betreibt Grundlagenforschung in den Naturwissenschaften, der Mathematik und der Informatik. Zu den Hauptforschungsrichtungen zählen komplexe Simulationen auf verschiedenen Skalen, Datenwissenschaft und -analyse sowie die Entwicklung rechnergestützter Tools für die Forschung. Die Anwendungsfelder reichen von der Molekularbiologie bis zur Astrophysik. Ein wesentliches Merkmal des Instituts ist die Interdisziplinarität, die in zahlreichen gruppen- und disziplinübergreifenden Projekten umgesetzt wird. Die Grundfinanzierung des HITS wird von der Klaus Tschira Stiftung bereitgestellt.
