Neue Peptide zur Überwindung von Medikamentenresistenz bei Ovarialkarzinomen
Italienische und deutsche Forscher haben Peptide entwickelt, die gegen die Protein-Protein-Kontaktfläche eines Schlüsselenzyms der DNS-Synthese gerichtet sind. Das Enzym Thymidylat-Synthase ist wichtig für Krebswachstum. Durch einen neuartigen Mechanismus hemmen die Peptide das Wachstum der medikamentenresistenten Ovarialkarzinomzellen. Das interdisziplinäre Projekt wurde von Forschern der Universität Modena und Reggio Emilia (UNIMORE), der Universität Siena (UNISI) und des Heidelberger Instituts für Theoretische Studien (HITS) geleitet.
Heidelberg/Modena/Siena. Weltweit werden jedes Jahr bei mehr als 200.000 Frauen Ovarialkarzinome diagnostiziert. Die Industrieländer sind stärker betroffen: Ovarialkarzinome sind dort sogar die fünfthäufigste durch Krebs hervorgerufene Todesursache bei Frauen. Die Sterblichkeitsrate bei Ovarialkarzinomen ist hoch, da sie häufig erst spät diagnostiziert und schnell gegen Medikamente resistent werden. Einige klinisch bedeutsame und häufig in der Chemotherapie eingesetzte Krebsmedikamente hemmen die Thymidylat-Synthase, ein Schlüsselenzym der DNS-Synthese. Der Einsatz dieser Mittel führt jedoch häufig zu einer Medikamentenresistenz, so dass neue Verbindungen mit anderen Wirkmechanismen benötigt werden.
Forscher aus Italien und Deutschland haben Octapeptide entwickelt, die spezifisch an die Protein-Protein-Kontaktfläche der Thymidylat-Synthase binden. Die Thymidylat-Synthase besteht aus zwei identischen Polypeptidketten, das heißt, sie ist ein sogenanntes Homodimer. Die Peptide stabilisieren die inaktive Form des Enzyms, was einen neuartigen Mechanismus zur Hemmung homodimerer Enzyme darstellt. Mit diesen Peptiden gelingt es, das Zellwachstum sowohl medikamentenempfindlicher als auch medikamentenresistenter Krebszelllinien zu hemmen.
Die Leitung der interdisziplinären Kooperation zwischen Wissenschaftlern in Italien und Deutschland lag bei Maria Paola Costi und Glauco Ponterini (Universität Modena und Reggio Emilia), Stefano Mangani (Universität Siena) sowie bei Rebecca Wade (Heidelberger Institut für Theoretische Studien HITS). Die Kooperation war Teil des LIGHTS-Projekts („LIGands to interfere with human TS“), das vom 6. EU-Rahmenprogramm für Forschung, Technologische Entwicklung und Demonstration (FP6) gefördert wurde.
Dabei entdeckten die Forscher einige Peptide, die die Thymidylat-Synthase hemmen, indem sie die Protein-Protein-Interaktionen modulieren. „Die Peptidsequenzen entsprechen Teilen der Protein-Protein-Kontaktfläche des Enzyms und hemmen die Enzymaktivität, indem sie an eine bisher unbekannte allosterische Bindungsstelle binden und nicht wie die klassischen Thymidylat-Synthase-Inhibitoren an das aktive Zentrum“, erklärt Maria Paola Costi. Mit einer Kombination aus experimentellen und computergestützten Ansätzen konnten die Forscher zeigen, dass der Hemmmechanismus die inaktive Form des Enzyms stabilisiert, anders als bisher bekannte Inhibitoren, die Protein-Protein-Kontaktflächen blockieren.
Mit den neuen Peptiden ist es möglich, die Aktivität der intrazellulären Thymidylat-Synthase und das Karzinomzellwachstum zu hemmen, ohne dabei die Konzentration des Enzyms zu erhöhen. Dadurch unterscheiden sie sich von den bereits vorhandenen Medikamenten, die bei der Behandlung von Ovarialkarzinomen zum Einsatz kommen. „Diese Beobachtung deutet auf den potenziellen Wert dieser Peptide bei der Überwindung der Medikamentenresistenz hin“, so Rebecca Wade. „Allerdings sind die zellulären Effekte noch nicht vollständig erforscht.“ In weiteren Schritten müssen die gefundenen Verbindungen optimiert und ihr zellulärer Aktionsmechanismus im Detail analysiert werden. Die Ergebnisse dieser Arbeit eröffnen neue Perspektiven für die Entwicklung von Medikamenten gegen Krankheiten wie Ovarialkarzinome.
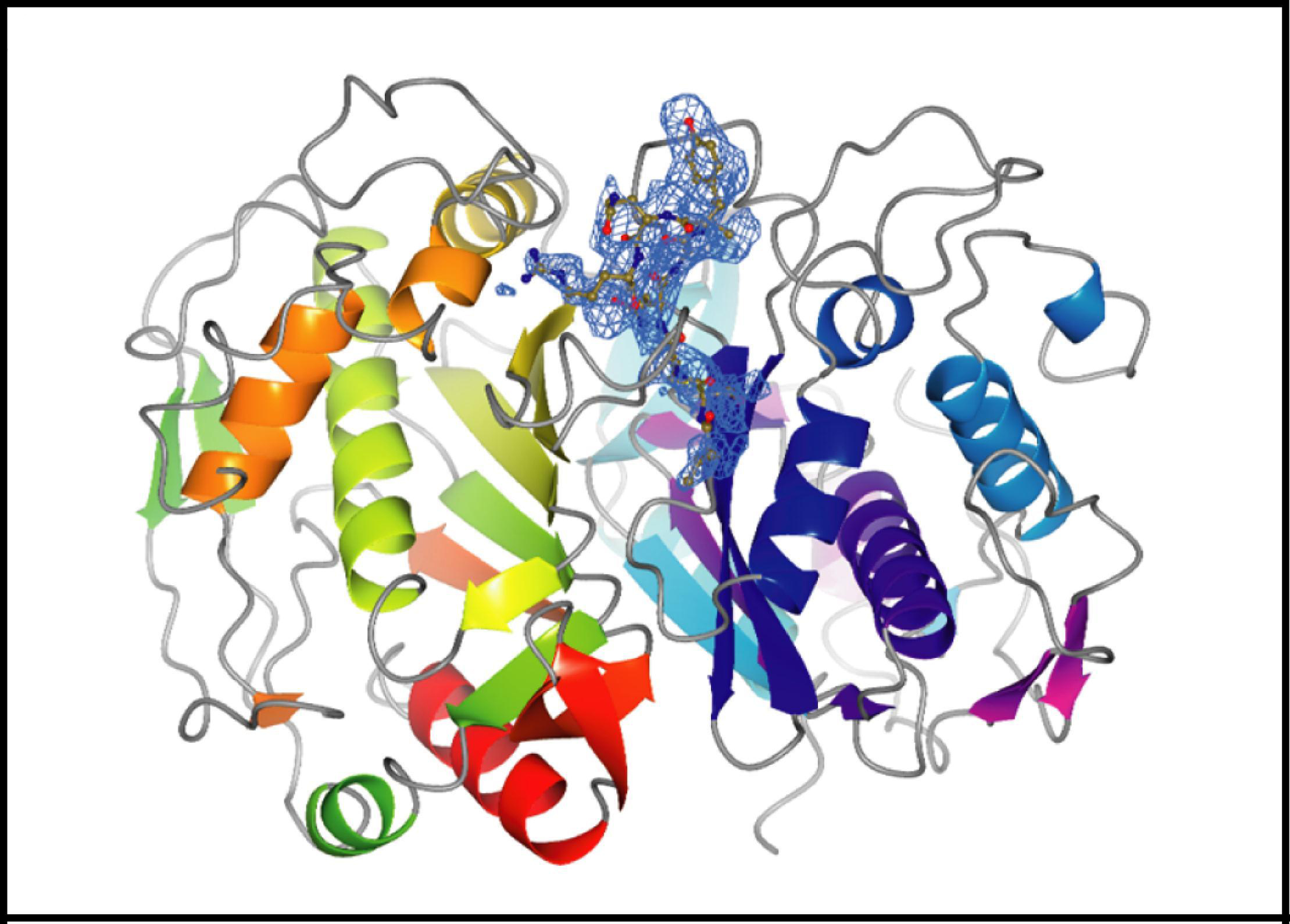
Abbildung:
Kristallstruktur der humanen Thymidylat-Synthase mit einem an die Dimer-Kontaktfläche gebundenen hemmenden Peptid. Die Sekundärstruktur des Proteins ist schematisch in Regenbogenfarben dargestellt. Die blauen Linien zeigen die Elektronendichte des gebundenen Peptids, die Atome sind je nach Atomtyp in unterschiedlichen Farben markiert.
Der wissenschaftliche Artikel im Original:
Cardinale et al., Protein-protein interface-binding peptides inhibit the cancer therapy target human thymidylate synthase. PNAS (2011) 27 July 2011 (published online before print).
doi: 10.1073/pnas.1104829108
Pressekontakt:
Dr. Peter Saueressig
Public Relations
Heidelberger Institut für Theoretische Studien (HITS)
Tel.: +49-6221-533-245
Fax: +49-6221-533-198
peter.saueressig@h-its.org
www.h-its.org
Wissenschaftliche Kontakte:
Prof. Maria Paola Costi
Dipartimento di Scienze Farmaceutiche,
Universita degli Studi di Modena e Reggio Emilia,
Via Campi 18,
41100 Modena,
Italien
Tel.: 0039-0592055125
Fax: 0039-0592055131
mariapaola.costi@unimore.it
Prof. Stefano Mangani
Dipartimento di Chimica,
Università degli Studi di Siena,
Via Aldo Moro 2,
53100 Siena,
Italien
Tel.: 0039-0577-234255
Fax: 0039-0577-243233
mangani@unisi.it
Dr. Rebecca Wade
Molecular and Cellular Modeling Group
Heidelberg Institute for Theoretical Studies (HITS)
Schloss-Wolfsbrunnenweg 35
69118 Heidelberg
Deutschland
Tel.: +49 6221 – 533 – 247
Fax: +49 6221 – 533 – 298
rebecca.wade@h-its.org
Universität Modena und Reggio Emilia (UNIMORE)
UNIMORE ist eine der ältesten Universitäten Europas mit heute über 20.000 Studierenden. Acht der zwölf Fakultäten dieser Forschungsuniversität liegen in Modena, darunter auch die Fakultät für Biologie und Biotechnologie mit der Abteilung für pharmazeutische Wissenschaften.
www.unimore.it
Universität Siena (UNISI)
UNISI ist eine der ältesten Universitäten Italiens und hat heute etwa 20.000 Studierende. Die Universität hat neun Fakultäten, darunter auch die mathematisch-naturwissenschaftliche Fakultät mit der Abteilung für Chemie.
http://www.unisi.it
Über das HITS
Das HITS (Heidelberger Institut für Theoretische Studien) wurde 2010 von dem Physiker und SAP-Mitbegründer Klaus Tschira (1940-2015) und der Klaus Tschira Stiftung als privates, gemeinnütziges Forschungsinstitut gegründet. Es betreibt Grundlagenforschung in den Naturwissenschaften, der Mathematik und der Informatik. Zu den Hauptforschungsrichtungen zählen komplexe Simulationen auf verschiedenen Skalen, Datenwissenschaft und -analyse sowie die Entwicklung rechnergestützter Tools für die Forschung. Die Anwendungsfelder reichen von der Molekularbiologie bis zur Astrophysik. Ein wesentliches Merkmal des Instituts ist die Interdisziplinarität, die in zahlreichen gruppen- und disziplinübergreifenden Projekten umgesetzt wird. Die Grundfinanzierung des HITS wird von der Klaus Tschira Stiftung bereitgestellt.